IA para la estratificación de riesgos: los modelos DL multimodales ofrecen un pronóstico mejorado para la embolia pulmonar
Tabla de Enlaces
Resumen
- Introducción
- Métodos
- Resultados
- Discusión
- Conclusiones, Agradecimientos y Referencias
5. Conclusiones
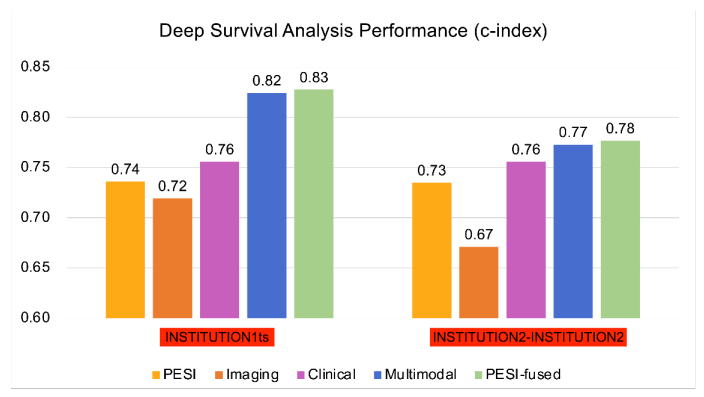
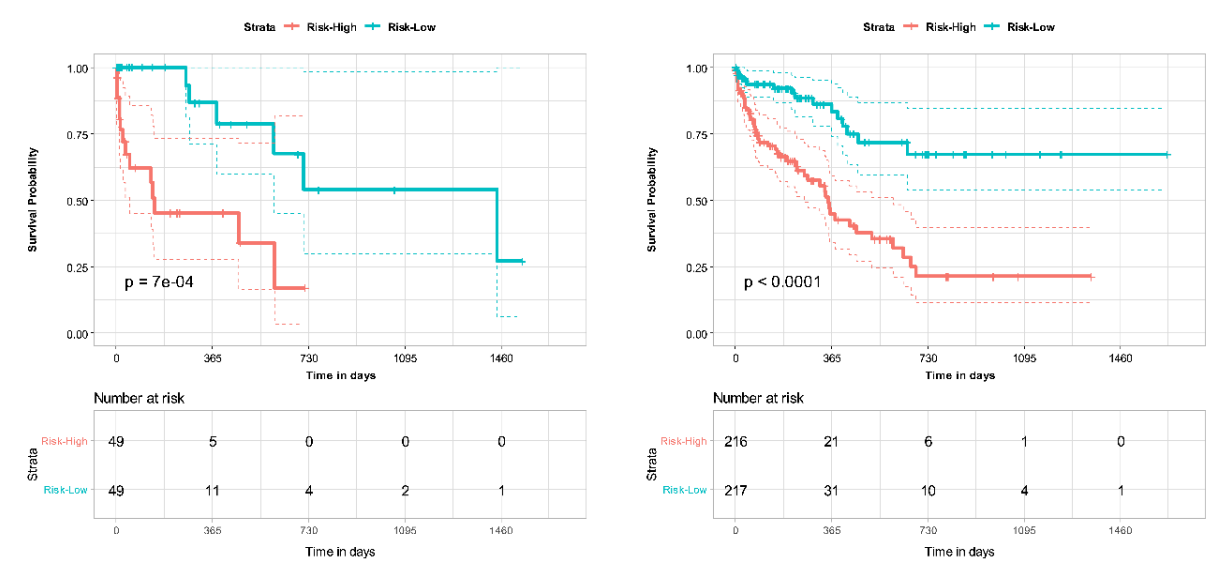
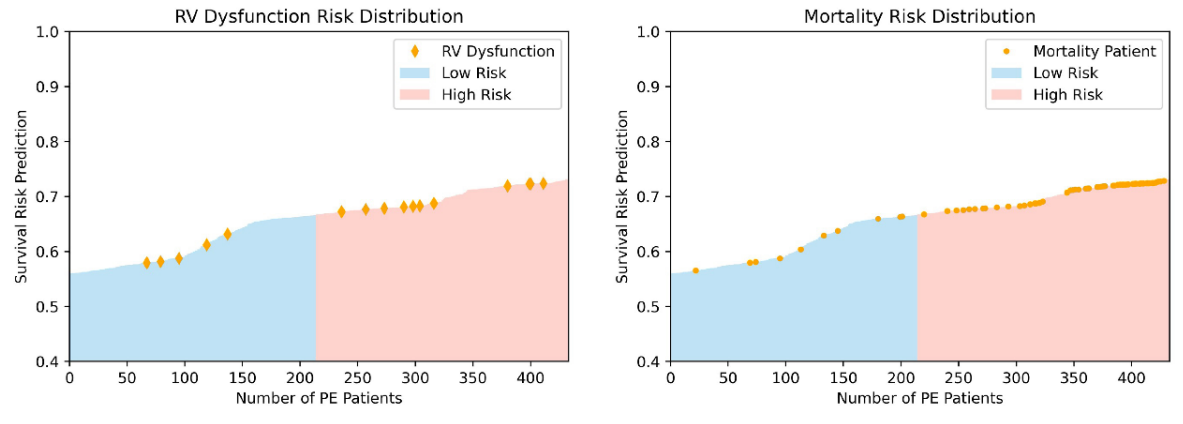
Los modelos DL multiómica basados en características CTPA combinadas y variables clínicas demostraron un rendimiento mejorado en comparación con la puntuación PESI sola para la predicción de mortalidad en EP. La adición de PESI al modelo multimodal demostró solo una mejora marginal del rendimiento, lo que ilustra que los modelos basados en IA son suficientemente capaces de predecir la supervivencia. Los modelos multimodales mejoraron de manera similar el rendimiento sobre PESI solo en la estimación del riesgo de mortalidad a 30 días. A través del análisis NRI, se demostró que los datos clínicos y de imágenes contribuyen de forma independiente a mejorar el rendimiento del modelo multimodal. Estos hallazgos demuestran la fortaleza de un modelo DL multimodal en comparación con el estándar clínico actual de PESI, convirtiendo el pronóstico en un proceso inteligente que integra mayor información clínica y de imágenes. Además, demostramos la concordancia de nuestro modelo con indicadores clínicos de mortalidad, como la disfunción del VD. Un análisis adicional puede arrojar más luz sobre la conexión de varios factores de riesgo con la mortalidad en pacientes con EP, y cómo esta información puede aprovecharse para el desarrollo de modelos en la predicción de supervivencia. Sin embargo, los beneficios de nuestro modelo solo pueden confirmarse mediante validación adicional en conjuntos de datos más grandes y diversos, así como pruebas prospectivas de los modelos desarrollados.
\ Nuestro estudio destaca la utilidad de los modelos basados en DL en el pronóstico y la estratificación de riesgo en pacientes con EP. La IA tiene el potencial de mejorar el flujo de trabajo clínico para radiólogos y médicos al proporcionar información diagnóstica y pronóstica rápida y precisa. Al ofrecer una estratificación de riesgo oportuna pero precisa para pacientes con EP, la IA puede ofrecer un beneficio sustancial a pacientes y proveedores al informar la toma de decisiones clínicas, potencialmente mejorando los resultados del paciente.
Agradecimientos
Ninguno.
Referencias
-
Beckman MG, Hooper WC, Critchley SE, Ortel TL. Venous thromboembolism: a public health concern. American journal of preventive medicine. 2010;38(4):S495-S501.
\
-
Lewis AE, Gerstein NS, Venkataramani R, Ramakrishna H. Evolving management trends and outcomes in catheter management of acute pulmonary embolism. Journal of Cardiothoracic and Vascular Anesthesia. 2022;36(8):3344-3356.
\
-
Goldhaber SZ, Bounameaux H. Pulmonary embolism and deep vein thrombosis. The Lancet. 2012;379(9828):1835-1846.
\
-
Piazza G, Goldhaber SZ. Acute pulmonary embolism: part I: epidemiology and diagnosis. Circulation. 2006;114(2):e28-e32.
\
-
Aujesky D, Obrosky DS, Stone RA, et al. Derivation and validation of a prognostic model for pulmonary embolism. American journal of respiratory and critical care medicine. 2005;172(8):1041-1046.
\
-
Donzé J, Le Gal G, Fine MJ, et al. Prospective validation of the pulmonary embolism severity index. Thrombosis and haemostasis. 2008;100(05):943-948.
\
-
Ishwaran H, Kogalur UB, Blackstone EH, Lauer MS. Random survival forests. 2008;
\
-
Fox J, Weisberg S. Cox proportional-hazards regression for survival data. An R and S-PLUS companion to applied regression. 2002;2002
\
-
Katzman JL, Shaham U, Cloninger A, Bates J, Jiang T, Kluger Y. DeepSurv: personalized treatment recommender system using a Cox proportional hazards deep neural network. BMC medical research methodology. 2018;18(1):1-12.
\
-
Oren O, Gersh BJ, Bhatt DL. Artificial intelligence in medical imaging: switching from radiographic pathological data to clinically meaningful endpoints. The Lancet Digital Health. 2020;2(9):e486-e488.
\
-
Weikert T, Winkel DJ, Bremerich J, et al. Automated detection of pulmonary embolism in CT pulmonary angiograms using an AI-powered algorithm. European radiology. 2020;30:6545-6553.
\
-
Huang S-C, Kothari T, Banerjee I, et al. PENet—a scalable deep-learning model for automated diagnosis of pulmonary embolism using volumetric CT imaging. NPJ digital medicine. 2020;3(1):61.
\
-
Huang S-C, Pareek A, Zamanian R, Banerjee I, Lungren MP. Multimodal fusion with deep neural networks for leveraging CT imaging and electronic health record: a case-study in pulmonary embolism detection. Scientific reports. 2020;10(1):22147.
\
-
Liu W, Liu M, Guo X, et al. Evaluation of acute pulmonary embolism and clot burden on CTPA with deep learning. European radiology. 2020;30:3567-3575.
\
-
Yao J, Zhu X, Zhu F, Huang J. Deep correlational learning for survival prediction from multi-modality data. Springer; 2017:406-414.
\
-
Vale-Silva LA, Rohr K. Long-term cancer survival prediction using multimodal deep learning. Scientific Reports. 2021;11(1):13505.
\
-
Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. New England Journal of Medicine. 2014;370(15):1402-1411.
\
-
Hofmanninger J, Prayer F, Pan J, Röhrich S, Prosch H, Langs G. Automatic lung segmentation in routine imaging is primarily a data diversity problem, not a methodology problem. European Radiology Experimental. 2020;4(1):1-13.
\
-
Harrell Jr FE, Lee KL, Califf RM, Pryor DB, Rosati RA. Regression modelling strategies for improved prognostic prediction. Statistics in medicine. 1984;3(2):143-152.
\
-
Leening MJ, Vedder MM, Witteman JC, Pencina MJ, Steyerberg EW. Net reclassification improvement: computation, interpretation, and controversies: a literature review and clinician's guide. Annals of internal medicine. 2014;160(2):122-131.
\
-
Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. Journal of the American statistical association. 1958;53(282):457-481.
\
-
Grifoni S, Olivotto I, Cecchini P, et al. Short-term clinical outcome of patients with acute pulmonary embolism, normal blood pressure, and echocardiographic right ventricular dysfunction. Circulation. 2000;101(24):2817-2822.
\
-
Coutance G, Cauderlier E, Ehtisham J, Hamon M, Hamon M. The prognostic value of markers of right ventricular dysfunction in pulmonary embolism: a meta-analysis. Critical care. 2011;15:1-10.
\
-
Chaudhary K, Poirion OB, Lu L, Garmire LX. Deep learning–based multi-omics integration robustly predicts survival in liver cancer. Clinical Cancer Research. 2018;24(6):1248-1259.
\
-
Somani SS, Honarvar H, Narula S, et al. Development of a machine learning model using electrocardiogram signals to improve acute pulmonary embolism screening. European Heart Journal-Digital Health. 2022;3(1):56-66.
\
-
Tourassi GD, Floyd CE, Sostman HD, Coleman RE. Acute pulmonary embolism: artificial neural network approach for diagnosis. Radiology. 1993;189(2):555-558.
\
-
Soffer S, Klang E, Shimon O, et al. Deep learning for pulmonary embolism detection on computed tomography pulmonary angiogram: a systematic review and meta-analysis. Scientific reports. 2021;11(1):15814.
\
-
Elias A, Mallett S, Daoud-Elias M, Poggi J-N, Clarke M. Prognostic models in acute pulmonary embolism: a systematic review and meta-analysis. BMJ open. 2016;6(4):e010324.
\
-
Cahan N, Klang E, Marom EM, et al. Multimodal fusion models for pulmonary embolism mortality prediction. Scientific Reports. 2023;13(1):1-15.
Figura
\ 
\ 
\ 
\ 
\ 
\ 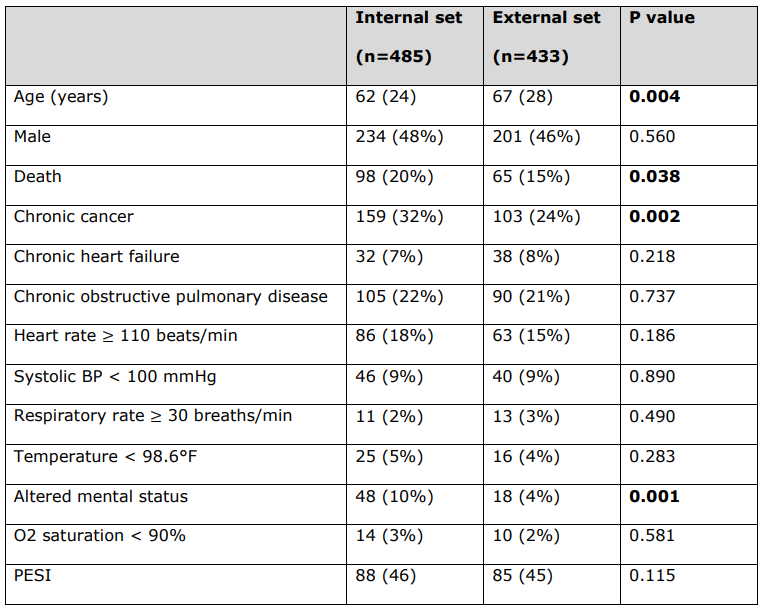
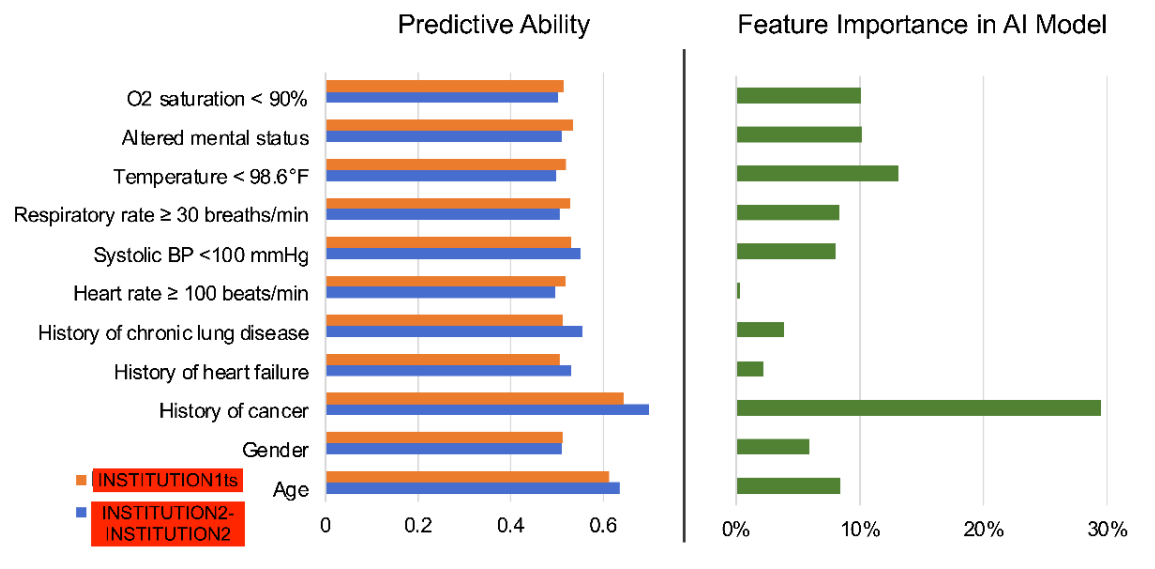
\ Características detalladas de los pacientes de las variables clínicas PESI utilizadas para calcular la puntuación PESI para cada paciente.
\ Todas las variables continuas se informan como mediana (rango intercuartil), y todas las variables categóricas se informan como número (%). Los valores p estadísticamente significativos están en negrita (p < 0,05). El estado de fallecido no es una variable clínica PESI.
\ BP = Presión Arterial. PESI =
También te puede interesar

Tether y Antalpha establecen un plan de 200 millones de dólares para expandir el alcance del token de oro

Discord emite alerta de filtración de datos que afecta a usuarios de criptomonedas
